di Michael Soncin
Un algoritmo utile per prescrivere cure antibiotiche personalizzate, capace di ridurre al minimo la resistenza agli antibiotici. Lo studio israeliano peer-reviewed (cioè che ha superato la revisione di altri scienziati dello stesso campo di ricerca ndr), pubblicato sulla rivista Science, è stato condotto dai ricercatori del Technion e dal Centro di Ricerca e Innovazione Maccabi KSM.
Secondo alcuni il primo a scoprire gli antibiotici fu il medico italiano Vincenzo Tiberio (1869-1915), che studiò il potere battericida di alcune muffe, anticipando di molti anni, circa 34, Alexander Fleming (1881-1955), con la scoperta nel 1929 della penicillina. Una rivoluzione scientifica che ha permesso di salvare e salva tutt’oggi miliardi di vite umane.
(Nell’immagine: allestimento di antibiogramma, in un terreno di coltura in vitro su piastra di agar, con al centro i dischetti imbevuti di antibiotico ed i relativi aloni indicatori formatisi attorno).
Sconfiggere l’antibiotico-resistenza è uno dei problemi del secolo
Da allora ne è stata fatta molta di strada, eppure, da un punto di vista generale, gli antibiotici, pur essendo indispensabili, maggiore è il suo utilizzo, minore tende ad essere la sua efficacia. Il rischio? La proliferazione di batteri ad essi resistenti, problema al quale gli scienziati stanno ormai lavorando da parecchio tempo.
Da un ciclo cellulare all’altro i batteri possono mutare il loro patrimonio genetico, concorrendo nello sviluppare la nota resistenza all’antibiotico somministrato, rendendo di fatto incurabile una malattia che prima si poteva curare, con conseguenze spesso fatali.
Una risposta al dilemma potrebbe arrivare nel prossimo futuro da Israele: utilizzando le tecniche di sequenziamento genomico, dopo aver isolato 1113 ceppi batterici prima e dopo il trattamento e incrociandoli con i dati delle cartelle cliniche di 200.000 pazienti che coprono un arco temporale di 8 anni, in cui si è tenuto conto dell’età, del sesso e dello storico delle re-infezioni, i ricercatori hanno elaborato un algoritmo per individuare una più mirata somministrazione del farmaco, che consentirebbe di ridurre del 50% il rischio di antibiotico-resistenza.
Nell’indagine sono state prese in esame le due tipologie di infezioni più comuni: del tratto urinario e da ferita, arrivando alla conclusione che lo storico di ciascun paziente può essere utile per l’individuazione del miglior antibiotico, limitando di moltissimo l’insorgere dell’antibiotico-resistenza.
Una migliore personalizzazione delle prescrizioni farmacologiche
Come sappiamo il trattamento clinico delle infezioni si concentra sulla corretta corrispondenza dell’antibiotico utilizzato in relazione alla resistenza dell’agente patogeno, ma pur essendo allineati questi fattori, l’esito può fallire a causa della resistenza che potrebbe nascere durante il trattamento stesso. Per quale motivo? Di che cosa si sono accorti? Hanno osservato che nella maggior parte dei casi la resistenza alle infezioni non era dovuta alle mutazioni, ma alla re-infezione di batteri resistenti già presenti nel microbioma del paziente.
Perciò la scelta farmacologica deve tenere conto anche di quest’ultimo parametro, ed è qui spiegata la chiave del successo individuata dagli scienziati, inserire nei dati incrociati anche questo elemento.
“Spero di vedere questo algoritmo messo in pratica nei centri di assistenza, al fine di dare ai medici strumenti migliori, necessari a personalizzare le cure antibiotiche, per migliorare il trattamento e ridurre al minimo la diffusione della resistenza”, ha detto Tal Patalon.
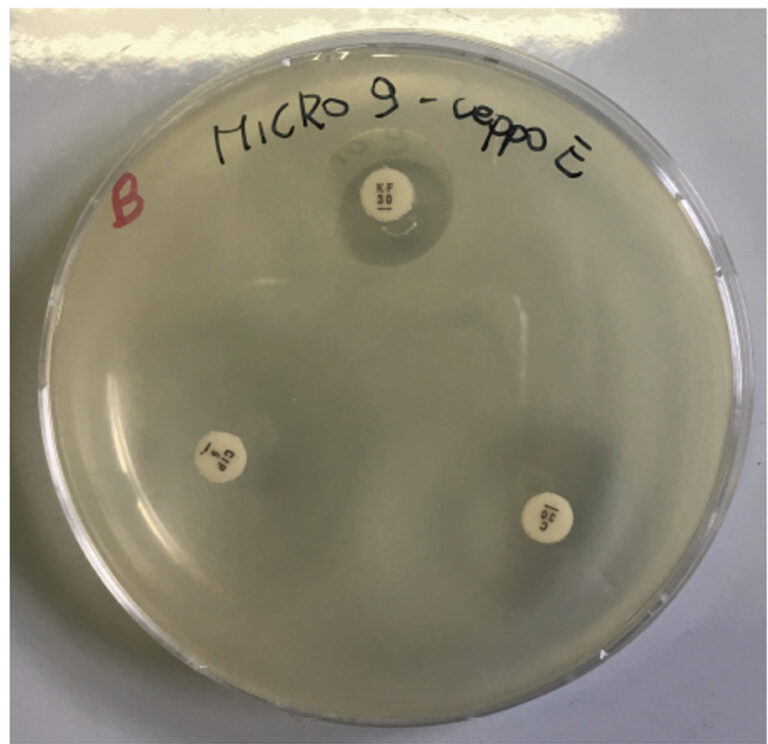
Che cos’è l’antibiogramma?
Uno dei metodi per individuare la giusta relazione fra il migliore farmaco antibiotico da somministrare e il tipo di patologia presente – infezione batterica – è di servirsi di un antibiogramma (ABG). Si tratta di un esame microbiologico effettuato in laboratorio che permette di verificare quanto la specie batterica è sensibile al farmaco utilizzato.
In che modo viene effettuato? Si preleva del campione biologico (urine, sangue, tamponi fatti sulla ferita) dove potrebbe essere presente la potenziale infezione, lo si allestisce in una coltura in vitro (urinocoltura, per l’urina, emocoltura, per il sangue, etc.), dove verranno messi dei dischetti imbevuti di antibiotico, per testarne l’efficacia.
Dopo diverse ore, attorno al dischetto si dovrebbe formare un alone. Come lo si interpreta? Semplificando e senza andare in ulteriori dettagli, se maggiore è l’alone attorno al dischetto, maggiore è l’efficacia dell’antibiotico, se invece è minore l’alone, vuol dire che il battere è più resistente all’antibiotico.


